TELEFONIA
BEZPRZEWODOWA
Ogólny wzór
układu elektrodowego stosowanego w bateriach, a więc urządzeniach o
wielokrotnych możliwościach zasilania i ładowania: MHn/NiO(OH).
materiały
anodowe: MHn
Najczęściej
są to stabilne wodorki niestechiometrycznych związków międzymetalicznych o
wiązaniu metalicznym (metale grup od III do VIII):
a) LaNi5H6
b) TiFeH2 i ZrNiH3
c) TiNiHx 0<x=<2
d) Zr2PdH2
e) ZrV2H5,5 i ZrCr2H4,1
W
odniesieniu do materiału pod punktem a), układem wyjściowym jest związek
międzymetaliczny o wzorze LaNi5. Każda cząsteczka przy ciśnieniu
p = 2.5 atm. absorbuje 6 atomów wodoru
LaNi5 + 3H2 <--> LaNi5H6
Opisana
reakcja absorpcji/desorpcji wodoru jest odwracalna.
Wodór
jako atrakcyjne paliwo jest znacznie bardziej bezpieczny przy magazynowaniu go
w formie wodorków metali, niż jako skroplona ciecz. Reakcja chemisorpcji wodoru
z fazy gazowej ze związkami międzymetalicznymi zachodzi samorzutnie i
egzotermicznie już przy niskim ciśnieniu wodoru.
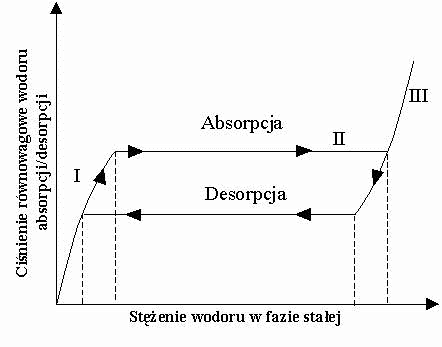
Izoterma
absorpcji i desorpcji wodoru przez związek międzymetaliczny.
Uzyskuje
się dużą gęstość objętościową wodoru przekraczającą na ogół gęstość
objętościową ciekłego wodoru przy nieporównanie mniejszym prawdopodobieństwie
wybuchu.
Reakcja
anodowa przebiega w alkalicznym wodnym roztworze elektrolitu, w wyniku której
uzyskujemy strumień elektronów przekazywany do obwodu zewnętrznego:
MHn + nOH-
<--> M + nH2O + ne-
gdzie M
jest symbolem związku międzymetalicznego.
Czyli np. (LaNi5)H6 +
6OH- <---> LaNi5 + 6H2O
+ 6e-
Reakcja
katodowej redukcji jest następująca:
6NiO(OH) +6e- + 6H2O
<--> 6Ni(OH)2 +6OH-
Ni 3+
+ e- <--> Ni 2+
Schemat baterii: MHn | KOHaq | NiO(OH)
Stopy
wieloskładnikowe odwracalnie absorbujące i desorbujące wodór stosowane są również
jako materiał elektrod wodorowych w ogniwach paliwowych.
W
odwracalnych wyżej omówionych bateriach alkalicznych jako najnowsze związki
wyjściowe do tworzenia chemiwodorków zaczęto stosować stopy międzymetaliczne o
składzie:
1) La 0,8 Nd 0,2 Ni2,5
Co 2,4 Si 0,1
2) Ti 0,98 Zr 0,02 V0,43 Fe 0,9 Cr
0,5 Mn 1,5
3) Ti 0,51 Zr
0,49 V0,76 Ni 1,18 Cr 0,21
Stopy
te wykazują dużą pojemność absorpcji wodoru już przy ciśnieniu zbliżonym do
atmosferycznego.
Akumulatory litowo-jonowe
W telefonii
bezprzewodowej jak również w wielu innych urządzeniach zwanych małą
elektroniką, do zasilania urządzeń stosuje się również najnowszej generacji
tzw. akumulatory litowo - jonowe W takim elektrochemicznym odwracalnie
pracującym ogniwie materiałem anodowym (źródłem elektronów) jest materiał
węglowy, np. grafity, grafitowane węgle, koksy z wprowadzonymi
(interkalowanymi) atomami litu, LixC6, a nie
czysty metaliczny lit, Li0.
|
|
|
|
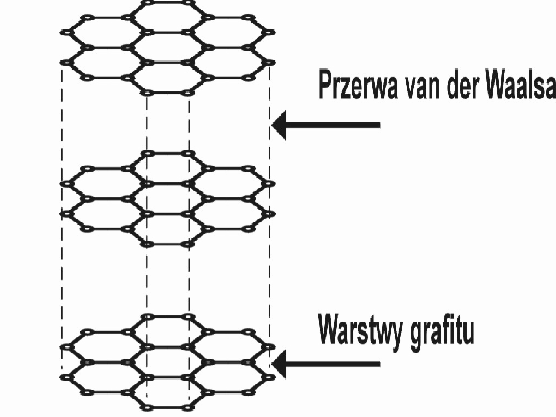
Struktura
grafitu. Słabe siły van der Waalsa wiążą warstwy węgli powiązanych siłami
kowalencyjnymi |
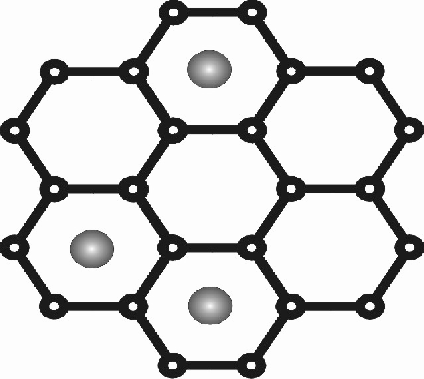
Struktura
grafitu i wprowadzone do niego atomy litu (rzut z góry). |
Przy
reakcji anodowego utleniania uzyskujemy strumień elektronów w obwodzie
zewnętrznym i strumień jonów Li+ w roztworze układu
elektrochemicznego
LixC6 <-->
6C + xLi+ + xe-
Atomy
litu są usieciowane w warstwowej strukturze grafitu.
Materiałem
katodowym są tlenki metali, np. dwutlenek manganu (MnO2), kobaltu
(CoO2), molibdenu (MoO2) niklu (NiO2) lub
tytanu (TiO2) o właściwościach półprzewodnikowych i strukturze
warstwowej. Jony litu w wyniku reakcji anodowej przechodzą w międzywarstwy np.
MnO2 tworząc związki interkalacyjne typu niestechiometrycznego Li1-xMnO2.
Bardzo często zamiast wymienionych tlenków metali, stosuje się już ich
interkalaty niestechiometryczne jako materiały katodowe: Li1-xMnO2
przy 1-x << 1.
Reakcja
katodowej redukcji:
MnO2 + xLi+ + xe-
<-->Li1-xMnO2
Schemat
akumulatora litowo – jonowego, przy zastosowaniu jednego z materiałów
katodowych, patrz Tab.1.
LixC6
| niewodny roztwór elektrolitu | Li1-xMn2O4
Tab. 1. Wybrane materiały anodowe
i katodowe, ich średnie napięcia (V) i teoretyczne energie właściwe (Wh/kg)
akumulatorów (baterii) litowo – jonowych.
|
Anoda |
katoda |
średnie napięcie (V) |
teor. en. właściwa(Wh/kg) |
|
LiXC6
(k) |
Li1-XCoO2 |
3,5 |
276 |
|
LiXC6
(k) |
Li1-XNiO2 |
3,4 |
321 |
|
LiXC6
(k) |
Li1-XMn2O4 |
3,7 |
305 |
|
LiXC6 (g) |
Li1-XCoO2 |
3,6 |
360 |
|
LiXC6 (g) |
Li1-XNiO2 |
3,5 |
444 |
|
LiXC6
(g) |
Li1-XMn2O4 |
3,8 |
403 |
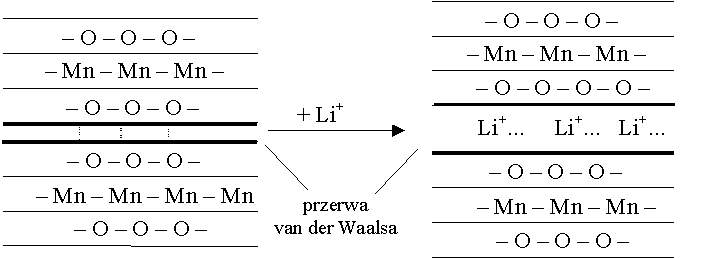
Struktura warstwowa omawianych tlenków metali
jako materiałów katodowych i wnikanie jonów litu z tworzeniem związków
interkalacyjnych. Schemat wnikania litu do przerwy van der Waalsa między
warstwami związku w MnO2.
A więc w
tych ogniwach wielokrotnego użytku, oba materiały elektrodowe są związkami
interkalacyjnymi.